近日,上海大學生命科學學院非編碼RNA與癌症實驗室副教授李豔利聯合複旦大學附屬腫瘤醫院邵楊和昆明醫科大學第三附屬醫院王紹佳課題組發現了在卵巢癌中低表達的hsa_circ_0001546通過結合14-3-3蛋白促進Tau蛋白磷酸化并誘導Tau蛋白聚集,進而促進脂質過氧化物的産生,誘導鐵死亡,最終在體外和體内抑制卵巢癌轉移的新機制,該工作以Tau Aggregation-Dependent Lipid Peroxide Accumulation Driven by the hsa_circ_0001546/14-3-3/CAMK2D/Tau Complex Inhibits Epithelial Ovarian Cancer Peritoneal Metastasis為題發表于知名期刊Advanced Science雜志(科學院分區一區,影響因子15.1)。
鐵死亡是一種由鐵依賴的磷脂過氧化引起的新型程序性細胞死亡,在癌症研究的早期階段就被發現與癌症密切相關。鐵死亡的兩個主要分子機制包括脂質過氧化和典型的GPX4調節的鐵死亡途徑,而脂質過氧化物(LPOs)的積累是鐵死亡的标志。目前Tau蛋白與鐵死亡的關系成為了研究熱點,盡管在神經退行性疾病中已經闡明了Tau和鐵死亡的關系,但在癌症中仍然缺乏相關的研究。
腹腔内擴散是上皮性卵巢癌(EOC)轉移的主要方式,其預後差、複發率高。環狀RNA(circRNA)是來源于前體mRNA(pre-mRNA)的共價閉合的單鍊轉錄本,參與調控多種癌症的發展。本研究通過對正常卵巢組織和卵巢癌組織進行RNA-seq二代測序篩選得到差異性低表達的hsa_circ_0001546,并且與正常卵巢組織相比,hsa_circ_0001546在EOC原位竈和轉移竈中低表達,說明其對EOC總生存期(OS)和無病生存期(DFS)具有良好的影響。本研究通過RNA pull-down、質譜檢測和RNA結合蛋白免疫沉澱(RIP)實驗發現其能夠與14-3-3蛋白家族的多個成員結合。鑒于14-3-3蛋白家族成員具有高度同源性,作者進一步研究了hsa_circ_0001546與該蛋白結合的具體位點。選取結合豐度最高的蛋白成員YWHAH蛋白作為模闆,結果證明hsa_circ_0001546與YWHAH蛋白的第165-186 aa區域結合。進一步,利用免疫共沉澱(Co-IP)和原位鄰近連接(PLA)等實驗發現hsa_circ_0001546通過促進14-3-3介導的CAMK2D的招募而促進Tau蛋白磷酸化,從而使14-3-3結合的Tau蛋白從非磷酸化轉變為磷酸化(Ser324),導緻Tau蛋白聚集增加,從而誘導LPOs的積累并導緻LPO依賴性鐵死亡。在體内,用鐵死亡抑制劑ferrostatin-1和Tau蛋白抑制劑TRx0237治療可以阻斷hsa_circ_0001546對EOC細胞擴散的抑制作用,引起更明顯的腹膜種植轉移。
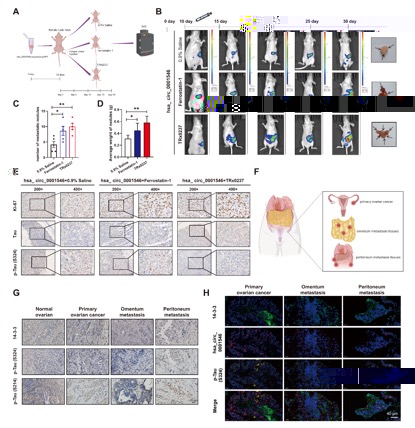
體内實驗表明hsa_circ_0001546/14-3-3/CAMK2D/p-Tau 複合體通過誘導Tau相關的鐵死亡抑制EOC腫瘤轉移
綜上所述,該研究結果為hsa_circ_0001546/14-3-3/CAMK2D/Tau複合物的存在提供了新的證據,Tau蛋白聚集導緻的鐵死亡不僅存在于阿爾茨海默病或帕金森病等神經退行性疾病相關細胞中,還發生在EOC細胞中,并且這種由hsa_circ_0001546/14-3-3/CAMK2D/Tau複合物驅動的鐵死亡是LPO依賴性的,而不是GPX4依賴性的。本研究通過一系列探索從鐵死亡角度探究了hsa_circ_0001546的功能,為卵巢癌的臨床診斷和靶向治療提供新的靶标。
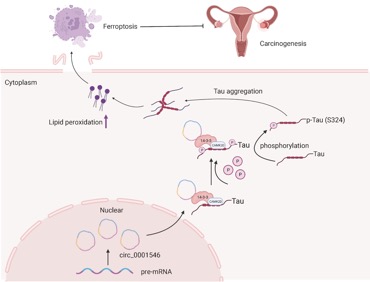
環狀RNA hsa_circ_0001546抑制EOC轉移的機理圖
上海大學碩士研究生柴彬淑,複旦大學附屬腫瘤醫院主治醫師吳勇和昆明醫科大學第三附屬醫院碩士研究生楊恒慧為共同第一作者。上海大學李豔利副教授、複旦大學附屬腫瘤醫院邵楊助理研究員及昆明醫科大學第三附屬醫院王紹佳副主任醫師為共同通訊作者。
文章鍊接:https://doi.org/10.1002/advs.202310134